登陆查看更多优秀资源帖,与同道便捷交流讨论
您需要 登录 才可以下载或查看,没有帐号?立即注册
x
蛋白质印迹法 (免疫印迹试验) 即 Western Blot,其工作原理是经过 PAGE (根据分子大小) 分离的蛋白质样品,转移到固相载体 (例如**纤维素薄膜) 上,然后将目的蛋白与特异性抗体进行孵化。由于抗体只与目的蛋白结合,未结合的抗体被洗掉,只留下与目的蛋白结合的抗体。最后通过显影检测结合的抗体,条带灰度与蛋白量相对应,因此可以反映蛋白质的表达情况[1]。
(如图 1)图 1. Western blot 的流程图[2]万丈高楼第一步:准备材料要想实验节奏稳,准备工作那可要妥妥的——缓冲液配制。小 M 在此总结了 WB 实验中所涉及的各类缓冲液的配方,拿走拿走别客气~

表 1. Western blotting 各类缓冲液配方 默默问一句,看完这些配方,您倦了吗?疯狂计算,反复称量,您累了吗?小 M 且在这里为您献上 MCE 多种速溶颗粒产品 (可戳往期→让“速溶颗粒”解放你的双手),不用犹豫,省时省力,您且受累收好呗! 只要样品做得好,完美结果少不了配好了溶液,就该轮到把样品的蛋白分离出来了!那么样品处理该注意什么呢? 低温操作!低温操作!低温操作!重要的事说三遍。为最大限度保证蛋白原有结构,所有涉及蛋白的操作都需在冰上进行! 1. 细胞裂解液的制备。在冰上用预冷的 PBS 洗涤细胞。根据每 107 个细胞加 1 mL 裂解缓冲液的比例加入预冷的裂解缓冲液。细胞重悬液在 4 ℃ 下放置 5-10 分钟,期间剧烈震荡 3-4 次,每次 30 秒,实现充分裂解。放入离心机内,12,000 rpm 离心 13-15 分钟。将上清液转移到冰上预冷的离心管中,弃去沉淀。 如果是制备组织裂解液的话,解剖目标组织一定要迅速,建议多次离心去除杂质。 2. 蛋白样本制备。取少量裂解液,通过 BCA 法进行蛋白浓度测定。取出 50 μg 蛋白对应的溶液至离心管中,加入 1×SDS 上样缓冲液调平体积。将样本缓冲液中的细胞裂解液在 100 ℃ 下煮沸 5-10 分钟。 上样跑胶需选择合适凝胶紧张又忙碌地制备完蛋白样品,然后就是上样和跑胶。(恰恰恰,跑个胶,先检查下作业呗!) 首先是根据蛋白大小选择合适的凝胶,参考下表 2。 然后将蛋白样品上样至 SDS-PAGE 凝胶孔中,记得在样品旁边的孔内点上 marker。细胞裂解液或组织匀浆的总蛋白上样量一般为 20-30 μg,电泳时长一般 1.5 小时,先用 80 V 跑 30分钟,使各样本处于同一水平,待 marker 开始分离后将电压调至 120 V 再跑 1小时。 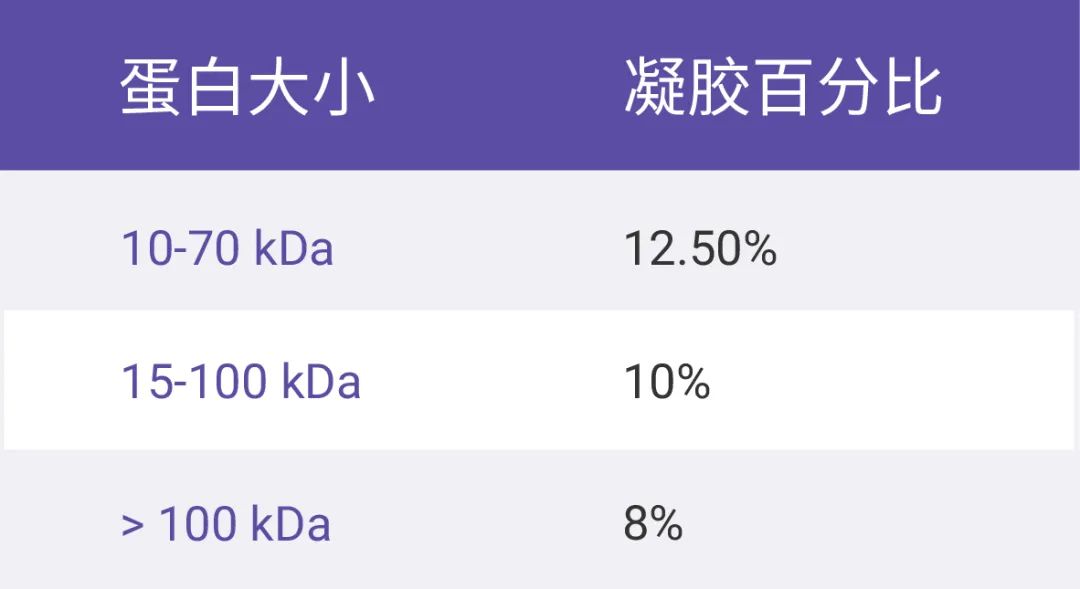 表 2. 蛋白大小与推荐的凝胶百分比 转膜不要丧气,成败在此一举顺利到了转膜这一步,已经快完成实验啦~ 转膜分为湿转和半干转两种,转膜时间应根据蛋白大小进行相应调整。 是指转印过程中凝胶和膜被浸入充满转印缓冲液的槽中,适用于大多数各种分子量的常规蛋白转印。半干转是指凝胶和膜被夹在预先润湿缓冲液的滤纸之间,滤纸与平板电极直接接触。湿转使用更广泛,成本低;半干转相对来说更加节约时间,通常只需要 10 min 即可,具体时间视蛋白大小和仪器条件决定。不论是半干转还是湿转,小 M 都有几个共通小 tips 要给你:2 转膜时要注意赶走膜与胶之间的气泡;(如图 2a) 图 2. 转膜的物料顺序:阴极,海绵 (湿转需要),滤纸,胶,PVDF 膜,滤纸,海绵 (湿转需要),阳极[3] 胜利的曙光:敷抗体显影通常,在孵育一抗前需要用封闭缓冲液在室温下封闭膜 1 小时,以使膜表面可有效地附着蛋白质或抗体,然后用 PBST 洗涤膜 3 次,每次 5 分钟,接着将封闭后的膜与稀释后的一抗在 4 ℃ 下过夜孵育。(注意注意:加入 ECL 显色液后应全程避光!否则前功尽弃。)。
M CE 的所有产品仅用作科学研究或药证申报,我们不为任何个人用途提供产品和服务 参考文献 [1] Mahmood T, Yang PC, et al. Western blot: technique, theory, and trouble shooting. N Am J Med Sci. 2012 Sep;4(9):429-34. [3] Wenying Pan, Wei Chen, and Xingyu Jiang, et al. Analytical Chemistry 2010 82 (10), 3974-3976
|