登陆查看更多优秀资源帖,与同道便捷交流讨论
您需要 登录 才可以下载或查看,没有帐号?立即注册
x
肿瘤微环境与微生物肿瘤的发展除了与癌细胞自身基因突变导致的恶性增殖有关以外,还与肿瘤微环境 (Tumor microenvironment, TME) 息息相关。在癌症中,正常组织中和谐的细胞互作关系被破坏,原本保护正常细胞生存的微环境在肿瘤细胞的影响下,逐渐演变成适应肿瘤生长的条件。例如正常巨噬细胞是参与免疫反应,吞噬病原体、死亡细胞等,而肿瘤相关巨噬细胞却能促进肿瘤生长、参与免疫抑制。无处不在的微生物也存在于肿瘤微环境中。2020 年 5 月,Ravid Straussman 团队在 Science 上发表了一项大规模肿瘤微生物组的研究结果。他们采集了 1526 份不同癌症类型患者样品,发现每种肿瘤类型都有不同的微生物组组成,例如,厚壁菌门和拟杆菌门的细菌在结直肠肿瘤中数量最多,变形杆菌在胰腺癌的微生物组中占主导地位。他们还通过代谢组学预测了肿瘤微生物的功能与其肿瘤微环境之间存在联系[1]。但这一研究并未证明肿瘤微生物是否在癌症的发展中起因果作用。今年 11 月,Susan Bullman 领导的研究小组在 Nature 上发表了一篇题为 Effect of the intratumoral microbiota on spatial and cellular heterogeneity in cancer 的研究性论文。他们采用空间转录组学来鉴定癌症患者患者肿瘤内微生物群落及其原位位置,还开发了一种单细胞 RNA 测序方法,用于识别细胞相关细菌和它们相互作用的宿主细胞。该研究结果揭示了肿瘤微生物促进癌症进展的作用[2]。
肿瘤微生物促进癌症进展■ 肿瘤内微生物群的异质性 研究者们首先对 11 例结直肠癌 (colorectal cancer, CRC) 患者的 44 块肿瘤组织进行了 16S rRNA 基因测序,发现在个体患者肿瘤中瘤内微生物门属水平上的种类有所不同,大部分患者 (n=7/11) 的瘤内微生物表现出不同程度的异质性,即一部分患者的瘤内微生物在组织中分布不均匀。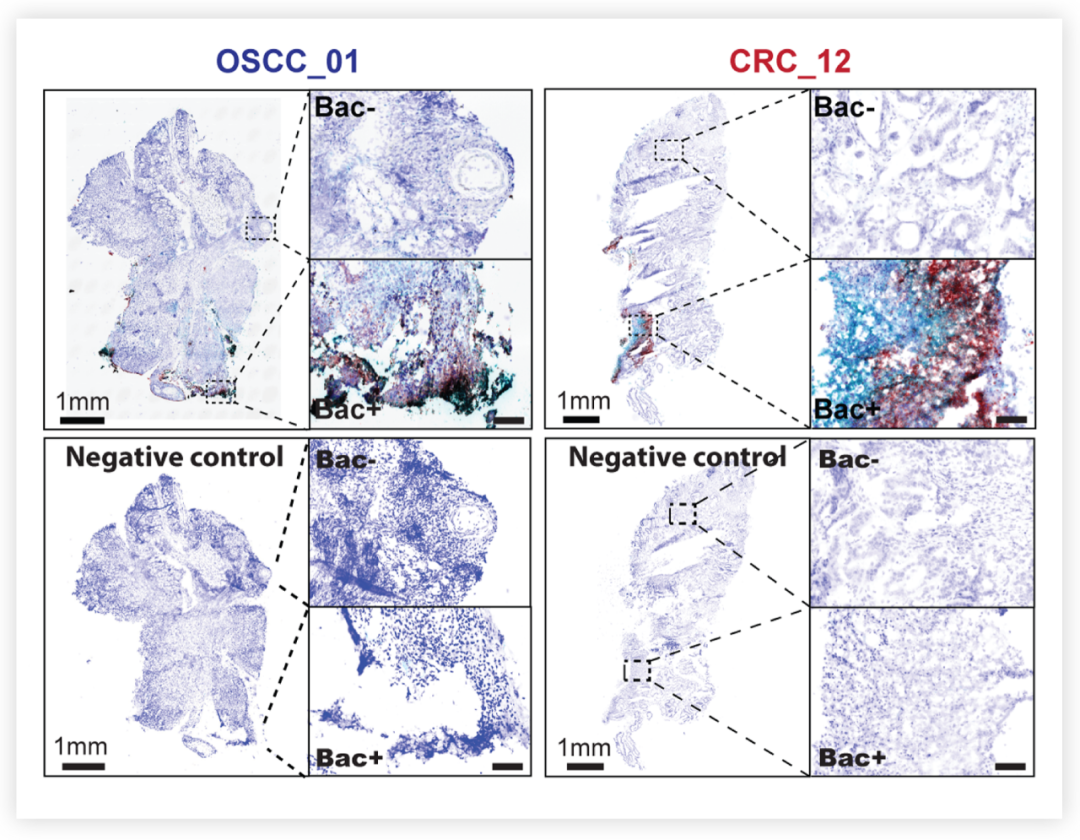 图 1. 具核梭杆菌 (Fusobacterium nucleatum) 和其他细菌群落在口腔鳞状细胞癌 (OSCC) (左) 和 CRC (右) 肿瘤组织中的空间分布[2]具核梭杆菌探针为红色,真细菌探针为青色;Bac- 为细菌阴性区,Bac+ 为细菌阳性区为了进一步研究瘤内微生物的分布空间和特性问题,研究者使用 10× Visium 空间转录组学对 CRC 样本和口腔鳞状细胞癌 (oral squamous cell carcinoma, OSCC) 样本进行无偏分析,定位细菌转录本空间坐标以及量化细菌转录量。细菌分布及载量如图 2a 所示,此外还发现,微单胞菌属 (Parvimonas)、嗜胨菌属 (Peptoniphilus) 和梭杆菌属 (Fusobacterium) 是 OSCC 肿瘤样本中最主要的属,梭杆菌属 (Fusobacterium) 和拟杆菌属 (Bacteroides) 是 CRC 肿瘤样本中最主要的属。 图 1. 具核梭杆菌 (Fusobacterium nucleatum) 和其他细菌群落在口腔鳞状细胞癌 (OSCC) (左) 和 CRC (右) 肿瘤组织中的空间分布[2]具核梭杆菌探针为红色,真细菌探针为青色;Bac- 为细菌阴性区,Bac+ 为细菌阳性区为了进一步研究瘤内微生物的分布空间和特性问题,研究者使用 10× Visium 空间转录组学对 CRC 样本和口腔鳞状细胞癌 (oral squamous cell carcinoma, OSCC) 样本进行无偏分析,定位细菌转录本空间坐标以及量化细菌转录量。细菌分布及载量如图 2a 所示,此外还发现,微单胞菌属 (Parvimonas)、嗜胨菌属 (Peptoniphilus) 和梭杆菌属 (Fusobacterium) 是 OSCC 肿瘤样本中最主要的属,梭杆菌属 (Fusobacterium) 和拟杆菌属 (Bacteroides) 是 CRC 肿瘤样本中最主要的属。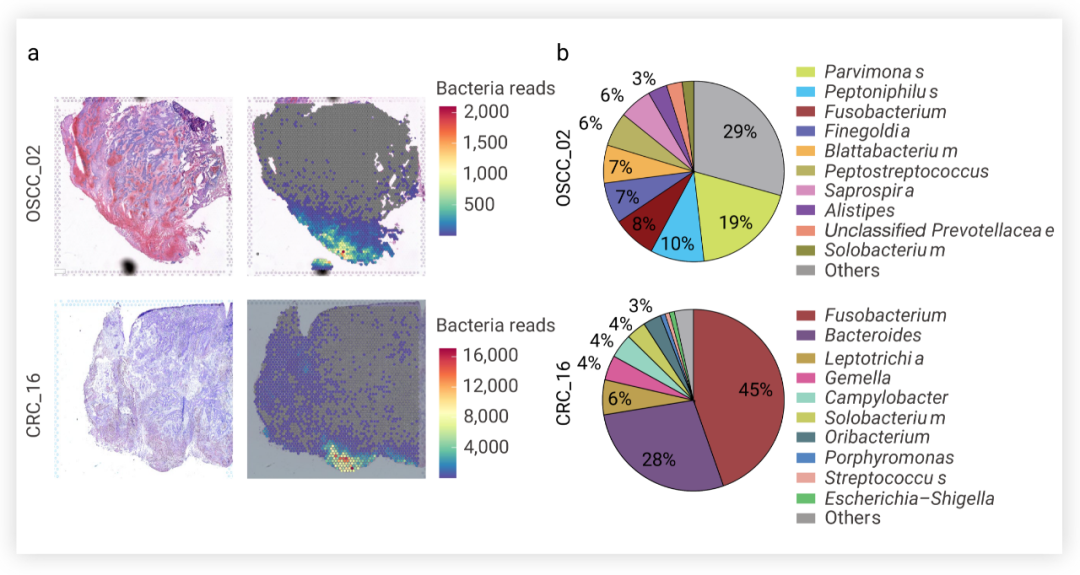
图 2. 肿瘤组织中瘤内细菌的空间分布[2] a. OSCC 和 CRC 肿瘤样本中细菌空间分布及转录量;b. OSCC 和 CRC 肿瘤样本中不同菌属占比■ 肿瘤内生态位被微生物定植为了确定瘤内微生物在个体肿瘤中的异质分布是否与 TME 的功能有关,作者团队通过 GeoMx 数字空间分析 (digital spatial profiling, DSP) 平台,使用靶向方法,量化了与抗肿瘤免疫和癌症进展相关的 77 种蛋白质的表达谱,对所感兴趣的免疫区室或上皮癌区室中的蛋白进行分区分析 (细菌阴性区 Bac- 与细菌阳性区 Bac+)。在 OSCC 和 CRC 肿瘤的 CD45+ 免疫区室中,细菌存在于高度免疫抑制的微生态位 (microniches),其特征是成熟 CD66b+ 骨髓细胞以及免疫抑制分子 ARG1 (精氨酸酶 1) 和免疫检查点蛋白 CTLA4 (细胞毒性 T 淋巴细胞相关蛋白 4) 的上调。此外,在两种癌症类型中,ERK1 和 ERK2 磷酸化水平升高,这表明骨髓对肿瘤内细菌的反应可能是通过激活 MAPK 信号通路发生的。在两种癌症类型的 PanCK+上皮肿瘤区室中,细菌定植区域 (Bac+) 的血管化程度低于细菌阴性区域 (Bac-),平滑肌肌动蛋白 (SMA) 表达减少,增殖水平降低 (图 3) (在连续的组织切片中,使用抗泛细胞角蛋白 (PanCK) 和CD45免疫荧光可标记上皮癌细胞和免疫区室在肿瘤组织的分布)。在 OSCC 和 CRC 肿瘤组织的细菌定植微生态位中,肿瘤抑制因子 p53 野生型构型的蛋白质表达显着降低,表明细菌定位与 TME 内高度转化的癌细胞相关。细菌定植的微生态位显着增加了 CRC 肿瘤中 JNK、ERK1 和 ERK2 以及 P38 的磷酸化水平,这一通路即为在细菌响应中被激活的信号通路。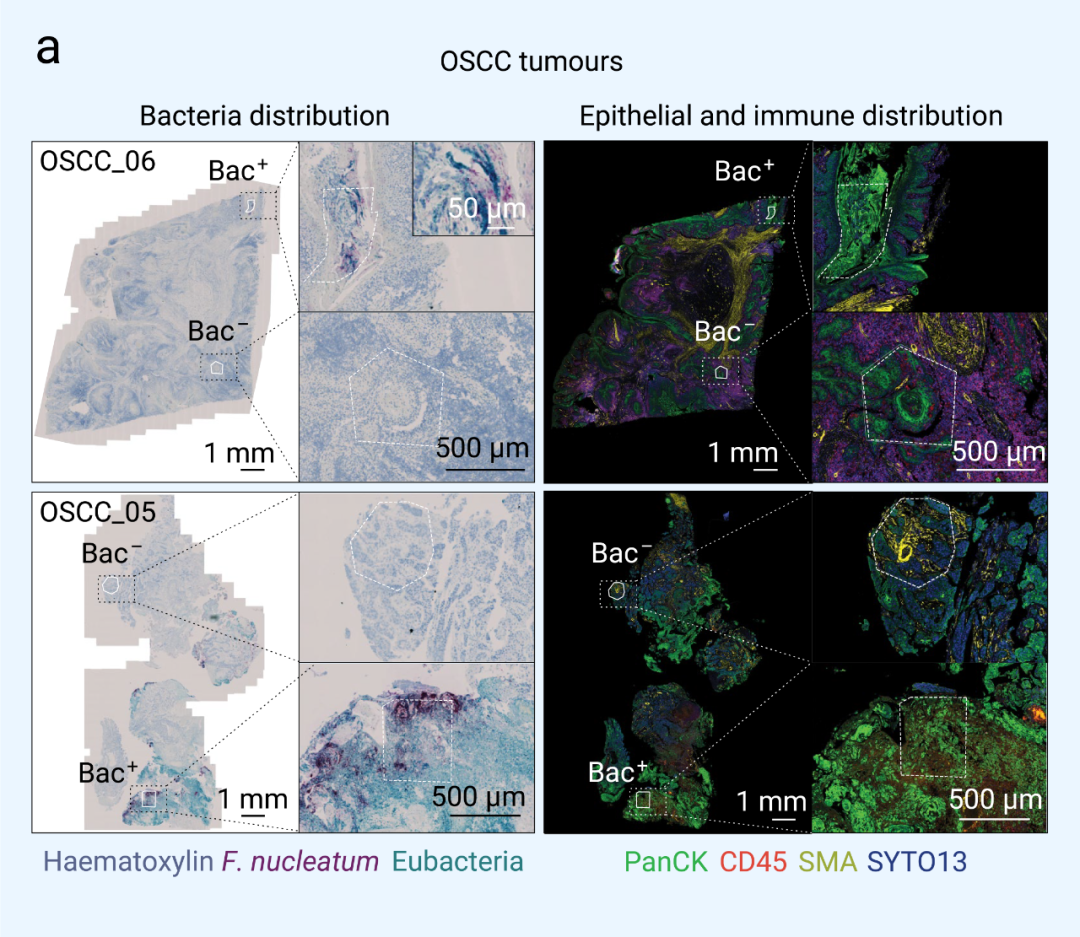 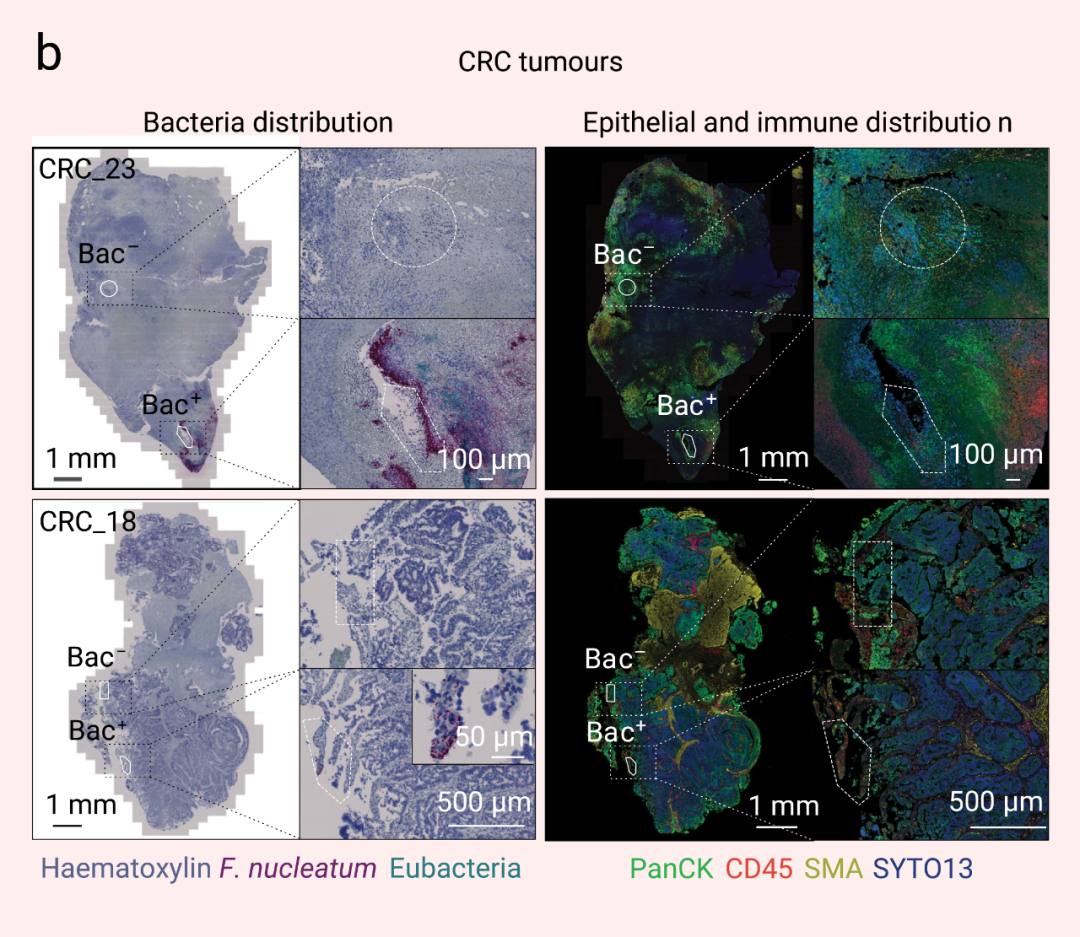 图 3. 肿瘤相关微生物群对局部微生态位的影响[2] RNascope-CISH 图像显示具核梭杆菌 (暗红色) 和其他细菌群落 (青蓝色) 在肿瘤组织中的分布,连续的免疫组织化学图像显示 CD45+ (红色) 和 PanCK+ (绿色) 细胞的分布,以分别鉴定肿瘤组织中的免疫和上皮区室。■ 微生物驱动的单细胞异质性为了研究 TME 中细菌-宿主细胞间的相互作用以及对宿主细胞转录组学的影响,作者团队通过引入靶向细菌 16S rRNA 保守区域的引物开发了侵袭-黏附定向表达测序法 (invasion-adhesion-directed expression sequencing, INVADEseq)。他们利用该方法检测了 7 位 OSCC 患者的新鲜肿瘤组织。共聚焦成像结果显示,在组织分离成单个细胞后,这些患者肿瘤的单个细胞内含有细胞粘附细菌和细胞内细菌 (图 4a)。这 7 份肿瘤样本的整合 scRNA-seq 结果显示,瘤内微生物区系以梭杆菌属 (Fusobacterium) (占 34%) 和密螺旋体属 (Treponema) (29.8%) 为主 (图 4b)。 为了确定这两种菌属是否影响上皮细胞的信号通路,作者团队将梭杆菌属或密螺旋体属阳性的单上皮细胞与上皮细胞簇中的细菌阴性细胞 (Total Bac-) 进行比较。GSEA分析结果显示,IFN 和 JAK-STAT 信号显著上调 (伴随 SERPIN 家族分子表达增加),趋化因子 (如 CXCL10, CXCL11, CCL4 和 CCL3) 以及金属蛋白酶 (MMP9 和 MMP3) 也显著上调 (图 4d-e)。另外还比较了泛细菌阳性 (Total Bac+) 与细菌阴性 (Total Bac-) 细胞之间的差异,结果显示,与感染特定菌属的细胞相比,泛细菌阳性上皮细胞中与癌症进展相关的基因表达和细胞信号通路仅受到很小程度影响。 这些结果表明,瘤内微生物可以在免疫和上皮细胞群的单细胞水平上驱动患者肿瘤的异质性。 瘤内细菌对宿主单细胞转录组学的影响[2]作者团队还探究了肿瘤内微生物群的主要菌属与免疫或上皮癌细胞的直接相互作用。他们将 CRC 上皮球状体与从 CRC 分离的具核梭杆菌共培养,然后包埋到含有均匀分布中性粒细胞的胶原蛋白基质中 。通过活细胞共聚焦显微镜发现,在没有具核梭杆菌的情况下,中性粒细胞在上皮球状体内自由迁移 -1 ± 0.08766 (s.e.m.。在有具核梭杆菌的情况下,中性粒细胞通过降低其迁移能力来应对细菌感染 min-1 ± 0.08561 (s.e.m.),平均细胞位移为 34.53 µm)另外,作者团队还发现,感染具核梭杆菌的 CRC 上皮细胞从球状体脱离,并作为单个上皮细胞迁移到周围的胶原蛋白基质中 。进入基质的被感染癌细胞以平均速度为 (s.e.m.)。这些结果表明,入侵癌细胞的细菌不仅促进了癌细胞在胶原基质中的扩散,而且还改变了受感染癌细胞的运动模式,从而在功能水平上促进了细胞的异质性。 

图 5. 具核梭杆菌诱导中性粒细胞聚集和癌细胞上皮细胞迁移[2]a. 活细胞共聚焦成像显示,在没有 (左) 或有 (右) 具核梭杆菌的情况下,与 CRC 球体相关的中性粒细胞运动状态;b. 共聚焦显微镜观察在没有 (左) 和有具核梭杆菌 (右) 的情况下 HCT116 细胞球体入侵胶原基质的状态。总结参考文献 1. Nejman D, Straussman R, et al. The human tumor microbiome is composed of tumor type-specific intracellular bacteria. Science. 2020 May 29;368(6494):973-980. 2. Galeano Niño JL, Bullman S, et al. Effect of the intratumoral microbiota on spatial and cellular heterogeneity in cancer. Nature. 2022 Nov;611(7937):810-817. |