登陆查看更多优秀资源帖,与同道便捷交流讨论
您需要 登录 才可以下载或查看,没有帐号?立即注册
x
神经退行性疾病是影响全球数百万人的高度致残且最终致命的疾病,主要包括肌萎缩侧索硬化症 (Amyotrophic lateral sclerosis, ALS)、帕金森病 (Parkinson's disease, PD)、阿尔茨海默症 (Alzheimer's disease, AD) 和亨廷顿病 (Huntington's disease, HD)。在神经退行性疾病中,特定的神经元亚群,例如多巴胺能和胆碱能神经元或运动神经元会逐渐退化,导致特定模式的神经系统功能障碍。传统药物治疗用于延缓疾病进展,不能使功能修复或组织再生[1]。
神经干细胞 (Neural stem cells, NSCs) 在神经系统的可塑性、衰老、疾病和再生方面具有重要作用。基于体内移植的 NSCs 具有自我更新、增殖、多向分化、低免疫原性和迁移的特点,NSCs 移植的成为了极具前景的一种神经系统疾病疗法,为脑损伤修复以及神经性疾病的治疗带来了希望。
关于神经干细胞及其分化
神经干细胞 (NSCs) 被喻为中枢神经系统 (CNS) 的 “种子” 细胞,不同神经细胞系的产生起源于成体神经干细胞。神经干细胞命运的调控更是一个精细的过程,依赖于从表观遗传延伸到翻译水平的复杂调控网络,且涉及细胞外基质成分[2]。
成体 NSCs 可以自我更新或响应特定刺激分化为神经元、星形胶质细胞或少突胶质细胞 (图 1),不同谱系的神经细胞功能各异。
图 1. NSCs 分化途径以及谱系特异性标志[3]
神经元 (Neurons) 是神经系统结构和功能的基本单位,通过轴突和树突传递信号。典型的神经元由树突、细胞体、轴突 (包括轴突丘) 和突触前末端组成。神经元自身不能再生。移植外源性 NSCs 或动员内源性 NSCs,使其分化为神经元,重建损伤的神经回路,是一种被广泛探索的治疗神经退行性疾病的方法。 星形胶质细胞 (Astrocytes) 是中枢神经系统 (CNS) 中最丰富的细胞类型,它们与神经元、少突胶质细胞和内皮细胞交流,并在结构上支持它们生长,整合为三联突触和神经血管单位,履行其功能。除了参与细胞通讯外,星形胶质细胞还能通过释放神经营养因子,如胶质细胞系衍生的神经营养因子 (GDNF),以及降低神经元的兴奋中毒,发挥神经保护作用。
少突胶质细胞 (Oligodendrocytes, OLGs) 是有髓鞘的胶质细胞,对神经元电绝缘、促进跳跃信号传导非常重要。少突胶质细胞还通过髓磷脂膜为神经元轴突提供代谢和营养支持,包括乳酸、丙酮酸和脑源性神经营养因子 (BDNF) 等神经营养因子。
神经干细胞,该如何培养?
可以通过三种不同的方法获得 NSCs (图 2):(1) 从原发性 CNS 组织直接提取,包括脑和脊髓组织;(2) 分化多能干细胞,例如胚胎干细胞和诱导性多能干细胞;(3) 转分化体细胞,如皮肤成纤维细胞和血细胞。从上述来源产生的 NSCs 可以通过基因改造,进一步永生化[1]。
图 2. NSCs 的来源[1]
如何有效地将 NSCs 诱导成特定的细胞类型? 神经营养因子、生长因子参与了 NSCs 增殖和分化的内源性调控,已被证明能诱导 NSCs 分化。目前已经开发了不同的 NSCs 分化方案。大多数都是基于含有生长因子的培养基,NSCs 在其中粘附和增殖。这些生长因子包括成纤维细胞生长因子 ( FGF) 和/或表皮生长因子 ( EGF)、神经生长因子 ( NGF)、脑源性神经营养因子 ( BDNF) 和胶质源性神经营养因子 ( GDNF) 等。
如在下文中,作者团队发表了一种快速、高效的分化方法,通过使用含有必要生长因子的选择性培养基从骨髓来源的细胞中生成小鼠 OLGs。通过该方案,可以在 7-8 周内获得成熟的 OLGs (与以前的工作相比,获得 OLGs 的时间更短)。
作者团队的方法主要包括三个步骤: 骨髓来源的 NSCs 生成、NSCs-OPCs 分化和 OLGs 成熟[4]。
骨髓来源的 NSCs 生成:收集骨髓组织切小块,消化,将细胞悬浮在无血清 DMEM/F12 中,添加 2% B27 补充剂, 20 ng/mL EGF 和 10 ng/mL bFGF ,同时添加 100 IU/mL 青霉素和 100 μg/mL 链霉素。随后将细胞悬浮在 NSC-PM (神经干细胞增殖培养基)中,并包裹于含聚 D-赖氨酸和层粘连蛋白的 24 孔板。10-14 天后,形成类似神经球的细胞团簇。
骨髓来源的 NSCs-OPCs 的分化和增殖:形成的神经球被消化到单细胞中,在 NSC-PM 中培养。每个孔中的神经球被消化成单细胞,在特定的 NSCs 分化培养基中培养。
星形胶质细胞分化时,DMEM 中添加 1% N2、2 mM GlutaMax-I 和 1% FBS。OLGs 分化培养基添加 2% B27、2 mM GlutaMax-I 和 20 ng/mL T3 的 neuro 培养基。2 周后,分化培养基中的 NSCs 形态发生变化,并且能检测到神经元、星形胶质细胞和 OLGs 的标记物。 OLGs 成熟:在 OLGs 成熟过程中,用 DPBS 缓冲液洗去生长因子 (PDGF-AA 和 bFGF),加入新鲜 EOLG-DM (早期 OLGs 分化培养基) 诱导 OLGs 分化,然后将在EOLG-DM 培养基中生长 4 天的 OPCs 转移到 LOLG-DM (晚期 OLGs 分化培养基) 中再生长 10 天,并通过添加 cAMP 加速 OLGs 分化的分支生长。
图 3. 从小鼠自体骨髓来源的 NSCs 中生成少突细胞祖细胞 (OPCs) 和少突胶质细胞[4]
此外,越来越多的科研人员关注多种神经营养因子/细胞因子联合使用。Kyung-Chul Choi 教授团队证明了生长因子的组合使用 (bFGF+IGF-I、bFGF+NGF、bFGF+BDNF、BDNF+IGF-I、bFGF+NGF) 对 NSCs 分化为神经元的效果比单个生长因子 (bFGF、IGF-I、BDNF 和 NGF) 处理结果更显著[5]。
NSCs 移植与阿尔茨海默症治疗
阿尔茨海默症 (Alzheimer's disease, AD) 是一种神经退行性疾病,由皮质和皮质下区域的神经元数量显著减少引起,其发展主要与淀粉样蛋白 (Aβ) 蛋白的积累和 Tau 蛋白的过度缠结相关。AD 的主要症状包括记忆力减退和认知障碍,大部分患者为老年人。AD 不仅降低老年人的生活质量,也加剧老龄化相关的经济负担,因此,AD 的治疗是众多研究者重点关注的课题。目前治疗 AD 的常用药物有多奈哌齐、卡巴拉汀、加兰他敏、他克林4 种乙酰胆碱酯酶抑制剂,以及 1 种 NMDA 受体拮抗剂美金刚。但药物无法再生已损伤或丢失的神经元,对于已有明显症状患者治疗效果并不明显。NSCs 能够自我更新并分化各种神经细胞,NSCs 移植疗法已显示出治疗 AD 的巨大潜力。移植后,NSCs 分化为神经元和/或神经胶质细胞并释放营养因子,从而修复 AD 引起的认知障碍 (图 4)。然而,尽管 NSCs 移植能再生神经元,但对已产生的 Aβ 却无法有效清除,这对移植后 NSCs 的存活也有不利的影响。对于 NSCs 的改造也是一个新兴的研究课题。
图 4. NSCs 移植途径及认知障碍修复机制:触发内源性突触形成、内源性神经形成影响行为表现、调节 Aβ 聚集[6]
接下来小 M 来介绍一个在 APPswe/PS1dE9 双转基因小鼠中移植 NSCs 治疗 AD 的例子~ 苏州纳米所王强斌团队开发了一种能够稳定和持续表达脑啡肽酶 (NEP) 的基因工程 NSCs。NSCs 经改造后,在细胞膜上表达的 NEP 和释放的胞外载体可持续降解 Aβ,提高 NSCs 和内源性神经细胞的存活率。PPAR-siSOX9 纳米制剂可通过协同调节 Wnt/β-catenin 和 RA 信号通路来提高 NEP-NSC 的分化效率。研究者们将改造的 PPAR-siSOX9 纳米制剂-NEP-NSCs 立体定向移植到 APPswe/PS1dE9 双转基因 AD 小鼠模型的海马体中(海马体是大脑中最容易受到 AD 病理学损伤形成的区域)。与对照组相比,经过治疗后的 AD 小鼠具有更高活力和更高密度的神经元,并且具有更高的存活率。治疗一个月后,大脑中的病理性 Aβ 聚集的斑块面积和大小也显著降低 (图 5)。在 Morris 水迷宫实验中证明,纳米制剂-NEP-NSCs 治疗小鼠更频繁地穿过平台并在目标象限中游泳的时间更长。这些结果表明,经改造后的纳米制剂-NEP-NSCs 在 AD 小鼠模型中能更有效地降解 Aβ 以及再生神经元,逆转了小鼠记忆与学习缺陷。 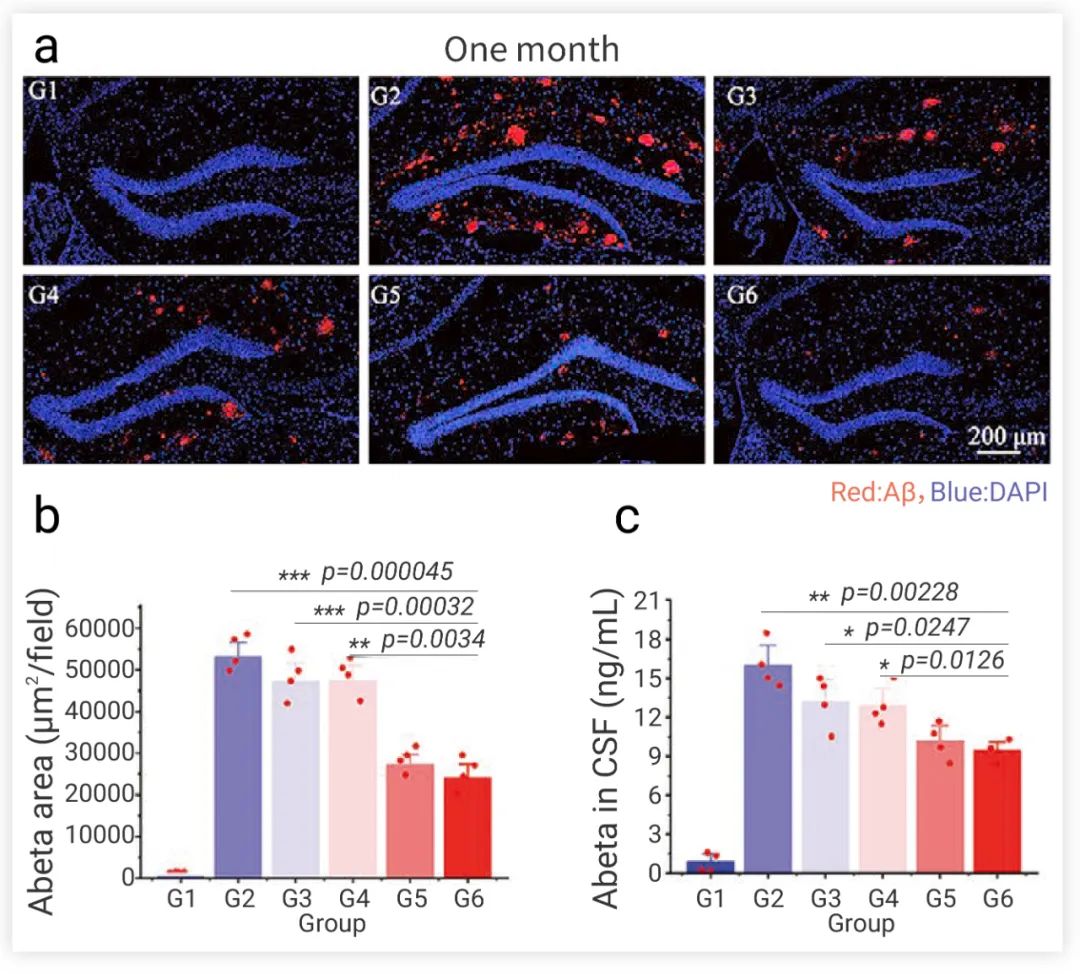 图 5. NSCs 移植治疗后 AD 小鼠大脑中 Aβ 定量检测。
图 5. NSCs 移植治疗后 AD 小鼠大脑中 Aβ 定量检测。G1:健康小鼠;G2:PBS 处理组;G3:NSC 治疗组;G4:纳米制剂-NSC 治疗组;G5:NEP–NSC 治疗组;G6:纳米制剂-NEP-NSC 治疗组[7]
除了阿尔茨海默症,在其他疾病如帕金森病 (PD)、肌萎缩侧索硬化症 (ALS)、亨廷顿病 (HD)、中风、创伤性脑损伤 (TBI) 等神经系统疾病的治疗中,NSCs 移植也表现出巨大的潜力。
表 1. 通过神经干细胞移植治疗神经疾病动物模型 (部分参考) [1]
PMID (从上至下):
17038899, 27213850, 25022790, 18683244, 27562609, 25132189
M CE 的所有产品仅用作科学研究或药证申报,我们不为任何个人用途提供产品和服务
参考文献 1. Yuewen Tang, L Cheng, et al. Current progress in the derivation and therapeutic application of neural stem cells. Cell Death Dis. 2017 Oct 12;8(10):e3108.
2. Yanjing Zhu, Ruiqi Huang, Liming Cheng, Rongrong Zhu, et al. Deep learning-based predictive identification of neural stem cell differentiation.Nat Commun. 2021 May 10;12(1):2614.
3. Roberta De Gioia, Stefania Corti, et al. Neural Stem Cell Transplantation for Neurodegenerative Diseases. Int J Mol Sci. 2020 Apr 28;21(9):3103.
4. Yuan Zhang, Xin-Yu Lu, Giacomo Casella, Jing Tian, Xing Li, et al. Generation of Oligodendrocyte Progenitor Cells From Mouse Bone Marrow Cells.Front Cell Neurosci. 2019 Jun 5;13:247.
5. Kyung-Chul Choi,Do-Sung Yoo, et al. Effect of Single Growth Factor and Growth Factor Combinations on Differentiation of Neural Stem Cells. J Korean Neurosurg Soc. 2008 Dec; 44(6): 375-381.
6. Hayashi Y, Tsai KJ, et al. Effects of neural stem cell transplantation in Alzheimer's disease models. J Biomed Sci. 2020 Jan 27;27(1):29.
7. Huang D, Wang Q, et al. A Nanoformulation-Mediated Multifunctional Stem Cell Therapy with Improved Beta-Amyloid Clearance and Neural Regeneration for Alzheimer's Disease. Adv Mater. 2021 Apr;33(13):e2006357.
|