登陆查看更多优秀资源帖,与同道便捷交流讨论
您需要 登录 才可以下载或查看,没有帐号?立即注册
x
作者:张睿,朱正鹏,马健波,罗锦 来源:《临床与实验病理学杂志》J Clin Exp Pathol 2015 Feb;31(2) 在日常病理工作中由于淋巴组织疾病分型多、异型性大易造成诊断困难。随着免疫组化技术的不断发展,检测系统和抗体种类的日趋丰富,免疫组化技术已成为淋巴组织病理诊断必不可少的手段之一。病理技术人员需不断提高淋巴组织免疫组化染色效果,以满足病理诊断的需求。 1.组织固定 良好的组织处理是制作优良病理切片的第一步。由于淋巴组织结构致密、细胞丰富且表面有被膜包绕,使固定液不易浸透易出现组织处理不良的现象。故取材宜新鲜,0.2~0.3cm厚,对于一些体积较小的淋巴结(图1)也应沿其纵轴正中切开固定。免疫组化理想的固定液应能保持高度的抗原反应且能显示良好的组织结构。但单纯固定液如汞对蛋白质有沉淀作用,可固定蛋白质,但穿透力低;甲醛渗透力强,收缩性小可保存脂类和糖类等物质,但是不能使白蛋白和核蛋白沉淀;醋酸能沉淀核蛋白,但不能沉淀白蛋白和球蛋白。单独使用效果均不理想。故标记淋巴组织抗原需综合以上几种单纯固定液(即B-5固定液)以达满意效果。固定液的量要充分,一般为组织块总体积的10~20倍。此外,需根据固定液的使用情况及时更换。 2.切片制作 切片是免疫组化染色过程中的重要环节。切片要求厚薄均匀,完整且无刀痕、细褶。2~3μm厚切片,切片太厚易影响免疫组化结果的判读且易掉片。工作中通常使用的醛类、醇类及二甲苯等均可导致组织变硬、变脆,特别是淋巴组织富含丰富的纤维,极易失去原有的柔韧度,变得干涸,造成切片困难。对于较硬的淋巴组织标本,作者建议进行软化处理:先将蜡块中的组织修出最大面,后将带有组织最大面的一面朝下短时间浸泡在沾有5mol/L盐酸的纱布或脱脂棉上,达到暂时软化组织蜡块的作用,处理后的标本可切出既完整又薄的切片。漂片时不能有气泡和皱褶,充分展平,展片可用30%乙醇与温水相结合法。从包埋到烤片,每一步的温度均需严格控制。温度过高会使蛋白变性损失抗原性,而温度过低则会导致掉片。本科室采用55℃烤片1h。烤片结束后,需趁热放入脱蜡液中。由于淋巴组织结构致密,脱蜡时间较一般组织需延长,以免脱蜡不彻底出现着色不均匀现象。 3.抗原修复 甲醛固定后蛋白质之间通过甲基化桥发生交联,从而影响抗原抗体结合。为达到满意的染色效果,提高抗原的检测率,选择适宜的方法进行抗原修复很重要。其中热修复方法最为常见,加热使抗原分子剧烈运动,缓冲离子在一定的条件下,扩张细胞膜的微细膜孔,增加膜的通透性,其金属离子、极性分子在微波电场力的作用下,高速运动直接碰撞在蛋白质上的交联,使之断裂。交联打开,暴露抗原决定簇,有利于抗原抗体结合。故在淋巴组织进行免疫组化标记时,为避免细胞膜的结构被破坏,通常不选用酶消化,而选择柠檬酸热修复的方法。但需根据不同的抗体选择适宜的修复时间。如CD20、溶菌酶等,按pH6.0柠檬酸缓冲液微波处理,中档8~10min,温度90~100℃能得到满意的效果。此外在临床实践中,作者还发现修复液的pH值对染色结果也有影响,选用pH 7.0、8.0的柠檬酸盐缓冲液均优于一般常规的pH 6.0,选择pH 8.0时染色效果最佳。但当修复液大于pH 8.0时会影响切片附着,造成脱片。 4.抗体稀释度 日常工作中使用的抗体种类繁多,包括即用型和浓缩型。在使用浓缩型抗体时,需特别注意抗体的稀释度。抗体浓度过高使抗原阳性细胞、阴性细胞和结缔组织均呈阳性反应,而浓度过低又会出现假阴性结果。故在使用抗体时,抗体使用说明书所标注的浓度仅作参考,需作“棋盘式效价”检测以达到合适的浓度。根据日常工作经验即用型抗体也可进行稀释。如即用型抗体κ经稀释后非特异性染色明显减少(图2),阳性部位定位准确,效果明显优于未稀释染色(图3)。由于再稀释比例过大会无法检测低水平抗原导致染色结果假阴性,因此即用型抗体再稀释时必须做好对照实验。稀释的抗体不能长期保存,4℃冰箱可保存1~3天,最好现用现配,且用高品质的抗体稀释液或商品化的工作液稀释。 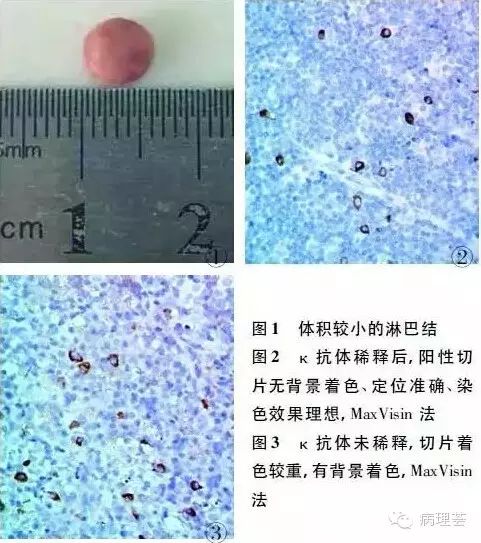
5.温度 温度在抗原抗体结合中的影响不容忽视。抗体孵育温度过高,即使孵育时间不长,也会出现组织背景过染的现象;低温下孵育,一抗孵育的时间越长,抗体的稀释度越高,特异性染色越强,非特异性染色也越低。故多采用一抗4℃湿盒孵育过夜的方法。在免疫组化MaxVisin法染色中二抗一般推荐室温孵育,但室温孵育易受季节、天气等影响,不易控制。温度过高室内空气干燥,抗体孵育过程中易出现组织干燥、染色背景过重,导致实验失败;温度过低,会影响抗原、抗体结合而出现假阴性。为解决这一问题,保证稳定的实验条件,可将切片放在湿盒中再置于37℃恒温箱中孵育。 6.显色系统和核复染 淋巴组织免疫组化表达一般以膜、质着色居多,多采用稳定性最强、色泽鲜艳的AEC和DAB显色系统。由于标本组织来源不同,细胞分化不一、抗原含量不等,因而抗原抗体反应的强度和反应所需的时间也不完全一致,要求借助光镜一边观察切片,一边控制呈色反应且一次加液的切片不易太多,以免因观察不及时导致显色过度,影响免疫组化染色的最终结果。对部分需要定量报告的抗体如ER、PR、Ki-67、HER-2等更要细心观察,逐一适时终止反应。由于在没有酶的情况下,H2O2也会游离出氧原子,与DAB发生反应从而降低DAB的显色效力,故显色液应现用现配。免疫组化复染只需苏木精浅淡的染色,淋巴组织细胞丰富,极易着色,若过深的苏木精染色有可能覆盖已有的阳性染色或与DAB显色对照效果减弱。苏木精复染时应适当缩短染色时间、多分化、彻底返蓝,才能达到对比明显、背景清晰的效果。
|