登陆查看更多优秀资源帖,与同道便捷交流讨论
您需要 登录 才可以下载或查看,没有帐号?立即注册
x
本帖最后由 晓晓 于 2015-12-1 15:00 编辑
作者:余英豪(男,教授,主任医师,硕士生导师),胡舜 作者单位:南京军区福州总医院病理科
胃肠胰神经内分泌肿瘤(gastroenteropancreaticneuroendocrine neoplasms,GEP-NENs)是一组形态学和生物学上呈明显异质性的肿瘤,既往对该类肿瘤的性质了解甚少。随着对肿瘤发病机制新进展的了解,WHO(2010)消化系统肿瘤分类对GEP-NENs的命名、分类和分级作了修订,并且将“类癌”术语从GEP-NENs中予以剔除。而后中国胃肠胰神经内分泌肿瘤病理诊断共识专家组又分别于2011年及2013年分别进行了“中国胃肠胰神经内分泌肿瘤病理诊断共识”的讨论与修改,形成的“共识意见”对GEP-NENs的诊断名称、分类和分级、规范性病理报告及一些争议性问题提出了建议。2013年中国临床肿瘤学会神经内分泌专家委员会亦就GEP-NENs临床相关问题提出了“中国胃肠胰神经内分泌肿瘤专家共识”。尽管如此,国内许多临床或病理学科对GEP-NENs的知识并未得到全面的更新。基于此,本文归纳了当前GEP-NENs临床病理值得关注的十个重要问题并加以阐述。
1、GEP-NENs的命名 根据国内外文献及临床病理专家共识,GEP-NENs有以下诊断名称及术语:(1)GEP-NENs,系指来源于胃肠道和胰腺神经内分泌细胞的肿瘤统称。GEP-NENs又分为胰腺神经内分泌肿瘤(pancreatic neuroendocrine neoplasms,pNENs)和胃肠道神经内分泌肿瘤(gastrointestinal neuroendocrine neoplasms,GI-NENs)两个部分。(2)神经内分泌肿瘤(neuroendocrine neoplasms,NENs),指所有源于神经内分泌细胞的肿瘤。包括高、中、低分化的NENs。(3)NENs又根据肿瘤分化程度不同分为:高、中分化神经内分泌瘤(neuroendocrine tumors,NENs)和低分化神经内分泌癌(neuroendocrine carcinoma,NENs)。值得注意的是,国外文献中使用“neuroendocrine tumors”的频率要远超过“neuroendocrine neoplasms”的使用。
2、GEP-NENs的病理学分类 关于GI-NENs尚未有一个能被广泛接受的分类分级系统,GEP-NENs的病理学分类更是几经变更。2013年“中国胃肠胰神经内分泌肿瘤病理诊断共识”和日本胃肠病学会(JGA)仍推荐使用WHO(2010)消化系统肿瘤分类标准,即将GEP-NENs根据分化程度分为:(1)高分化NET(NET-G1,NET-G2);(2)低分化NEC;(3)混合性腺神经内分泌癌(mixed adenoneuroendocrine carcinoma,MANEC)。中国病理诊断共识又从高分化NET中延伸出了第4条:部位特异性和功能性NET。不同部位的NEN分类上可略有不同,如阑尾高分化NET中,又分为肠嗜铬细胞NETs(enterochromaffin cell NETs)、肠胰高血糖素(L)细胞NETs(enteroglucagon Lcell NETs)及管状NETs(tubularNETs)3个组织学亚型。
3、GEP-NENs起源的新观点 早期研究认为胃肠道NEC起源于神经嵴,因此这些病变具有“神经内分泌”属性。即便目前一些学者仍坚持认为胃肠道中表达CgA、Syn的相关肿瘤含有神经内分泌颗粒。近期观点认为,胃肠道中既无正常的“神经内分泌细胞”,也无起源于神经嵴的器官系统内分泌细胞。上皮干细胞具有潜在异向分化产生内分泌细胞、潘氏细胞、杯状细胞和吸收细胞的能力。人体内弥散性内分泌系统的内分泌细胞表达不同的肽类标志物,如CgA、Syn和神经特异性烯醇化酶(NSE)被不正确理解为“神经内分泌”标志物。CgA是分泌功能性肽类物质(如胰抑制素、旁抑制素等)的前体蛋白,因此是内分泌分化最好的标志物。由此可见,把表达肽类激素的肿瘤归为内分泌肿瘤较合适,而只有明确的神经分化和内分泌分化的肿瘤才能称为“NENs”。真正意义上的神经内分泌细胞可见于脑垂体、交感神经链和肾上腺等部位,所产生的NENs包括副节瘤和嗜铬细胞瘤等。显然,将“NENs”用于描述胃肠道内分泌细胞表型的肿瘤是个误导。尽管如此,目前WHO和美国抗癌联合会(AJCC)分类方案仍沿用传统习惯,使用“NENs”术语表示具有特定形态学和免疫组化特征的胃肠道内分泌肿瘤。
4、GEP-NENs的分化与分级 GEP-NENs的恶性潜能判断,除了肿瘤部位、大小、浸润及转移外,在病理学上主要依据肿瘤细胞的分化程度及分级。“分化”和“分级”是两个不同的病理术语。分化程度是指肿瘤细胞与胃肠道正常内分泌细胞的相似程度,而分级是指肿瘤细胞的异型性程度。细胞异型性由一系列的特征组成,包括细胞核大小和轮廓、染色质分布模式、核仁突出程度、核分裂活性等。大多数GEP-NENs的组织学分级与分化程度呈负相关。即分化好的肿瘤倾向于呈低级别细胞学特征,而分化差的肿瘤几乎总是呈高级别细胞学特征。GEP-NENs根据核分裂数和免疫组化染色KI-67增殖指数分为高分化肿瘤(NETG1、G2)(图1~4)和低分化肿瘤(NECG3)。NEC又分为小细胞及大细胞两个类型(图5、6)。总体上讲,高分化肿瘤不易查见核分裂象,Ki-67增殖指数较低、无或仅有轻微坏死。低分化肿瘤显示高级别瘤细胞特征,如细胞核不规则、核染色质粗或空泡状、核分裂数多、增殖指数高、坏死常见,Ki-67增殖指数常>50%(表1)。Ki-67增殖指数2%~20%可能与肿瘤侵袭性生物学行为有关,即便肿瘤形态学特征为低级别。方法学上,核分裂活跃区至少计数50个HPF,Ki-67增殖指数计数应在核标记最强的区域计数500~2000个细胞的阳性百分比。普遍认为,在预测肿瘤生物学潜能时肿瘤分级比肿瘤形态学特征更为重要。 
图1胃NET(G1):分化良好的肿瘤细胞穿插于黏膜腺体之间
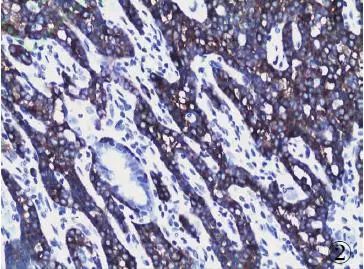
图2胃NET(G1):肿瘤细胞Syn阳性,黏膜腺体阴性,EliVision法
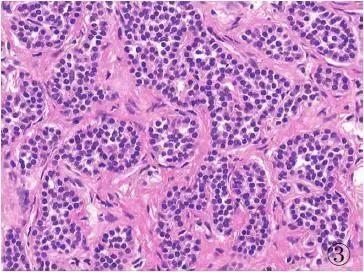
图3胃NET(G1):肿瘤细胞呈巢状排列
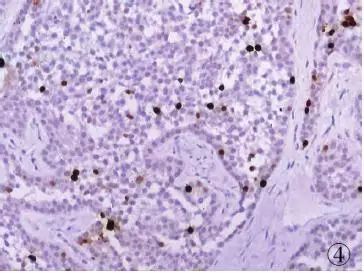
图4胃NET(G1):肿瘤细胞Ki-67增殖指数>2%,EliVision法
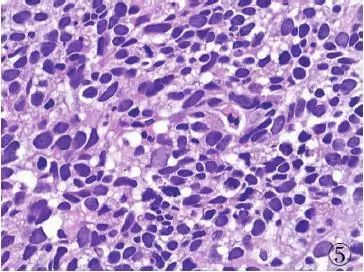
图5胃小细胞癌:肿瘤细胞核染色质细腻,核分裂象多见

图6胃LCNEC:肿瘤细胞核染色质与小细胞癌相似,但核仁突出
5、GEP-NENs的病理诊断报告 GEP-NENs的病理报告非常重要,多数机构均对规范病理报告的内容提出建议。GEP-NENs的病理报告所需要的信息包括肿瘤发病部位和类型、肿瘤分期和分级、肿瘤切除的完整性,以及Ki-67增殖指数等。2011年中国胃肠胰神经内分泌肿瘤病理学诊断共识建议,病理报告应当包括以下11项内容:标本类型、肿瘤部位、肿瘤大小和数目、肿瘤浸润深度和范围、脉管和神经累及情况、核分裂数(个/10HPF)和(或)Ki-67增殖指数、神经内分泌标志物(免疫组化):Syn和CgA表达、切缘情况、淋巴结转移情况、其他有关的改变、诊断(WHO分级和TNM分期)。活检标本可能无法面面俱到,但建议按上述内容一一对照报告。
6、MANEC 有些胃肠道肿瘤,如胃或结直肠肿瘤中含有大量的NEC和腺癌成分。即癌组织呈明显的恶性内分泌分化和腺样分化,每种癌成分占整个肿瘤量≥30%,WHO将其定义为MANEC。然而,这种指定应仅限于形态学上具有内分泌分化,并经免疫组化染色证实的病例,而不适用于免疫组化内分泌标志物阳性的普通型腺癌(图7~9)。MANEC中的腺癌成分起源于腺瘤-腺癌途径,而NEC成分起源于高-低分化NEN。值得注意的是,无论是腺癌中出现的散在神经内分泌细胞巢,或NEN中含灶性腺癌成分均不能诊断为MANEC。阑尾的MANEC通常起源于杯状细胞类癌(goblet cell carcinoids,GCC),多与浸润性腺癌合并存在,腺癌成分可包括印戒细胞癌、黏液癌、肠型腺癌和低分化癌。阑尾MANEC是否遵循内分泌分化和腺样分化成分各≥30%的诊断标准目前尚不清楚。AJCC认为应将GCC归为腺癌,并按腺癌进行分期。 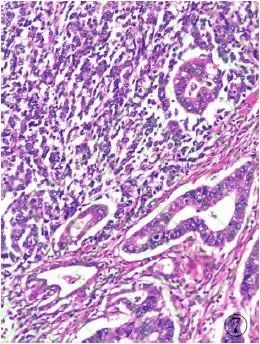
图7直肠MANEC:肿瘤组织显示腺癌及NEC两种形态
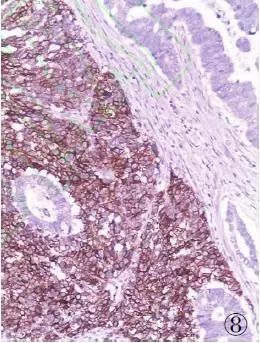
图8直肠MANEC:NEC细胞CD56阳性,腺癌细胞阴性,EliVision法
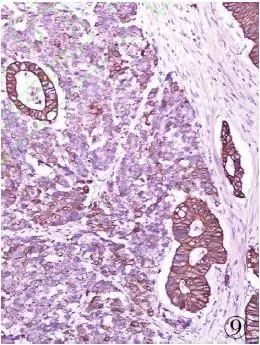
图9直肠MANEC:两种肿瘤成分CKpan均阳性,但腺癌弥漫强阳性表达,NEC成分表达强弱不等,EliVision法
7、NENS与伴神经内分泌分化肿瘤是两个不同的概念 如前所述,GEP-NENs与肿瘤伴神经内分泌分化是两个不同的概念,不能混淆,这与肿瘤的治疗方案等直接相关,因此准确区分及表述意义重大。前者系指肿瘤细胞具有神经内分泌的组织形态学特征,并且在免疫组化或超微结构上显示神经内分泌分化(神经内分泌颗粒)依据。而伴神经内分泌分化的肿瘤,其肿瘤细胞缺乏神经内分泌形态学特征,但有时在免疫组化上会表现神经内分泌分化特征(如CgA、Syn或CD56阳性),如胃肠道腺癌伴神经内分泌分化多见。Yao等对356例结直肠腺癌患者进行神经内分泌标志物表达研究,发现有近40%形态学上并无内分泌分化表现的结直肠腺癌表达CgA、Syn或NES。关于伴神经内分泌分化的胃肠道肿瘤的生物学行为,目前尚不明了。而肺的非小细胞肺癌伴神经内分泌分化,多数报道认为与预后无明显关联。
还有一些罕见的胃肠道肿瘤,如促纤维增生性小圆细胞肿瘤(desmoplasticsmall round cell tumor,DSRCT)、原始神经外胚层肿瘤(primitiveneurotodermal tumour,PNET)及伴横纹肌样表型的癌在免疫组化上也可表现出神经内分泌分化特征,同样,其神经内分泌分化特征具有诊断意义,多无临床或预后意义。
8、胃肠胰NET与NEC代表两种生物学行为独立的实体瘤 NET与NEC代表两种生物学行为独立的实体瘤已在NENs中得到证明。如肺的类癌和不典型类癌在临床表现、流行病学和遗传学方面均与肺大细胞神经内分泌癌(large cell neuroendocrine carcinoma,LCNEC)和小细胞肺癌(smallcell lung cancer,SCLC)有较大差异。同样,胃肠胰NET与NEC也不是一连续体(continuum)。GEP-NEN起源于上皮干细胞的分化,而发展转化为高分化NET或低分化NEC,其肿瘤发生的信号通路是完全不同的,表现在NET与NEC的肿瘤分期、5年生存率及无病生存率等生物学行为上的不同。至于低分化SCLC和LCNEC之间的关系,有学者利用显微切割技术评估肺混合型SCLC/LCNEC中独立的两种肿瘤成分,结果发现两种肿瘤成分均出现同样类型的基因异常,而这些基因异常却未出现在任一种单纯性肿瘤中。推测混合型肿瘤的两种成分可能为同一起源,可能代表LCNEC与SCLC之间的一种中间“转化”形式。因此认同高级别NEC的治疗多采用小细胞癌的治疗方案。Krieg等利用胃食管结合部LCNEC的肝转移瘤和大肠LCNEC的淋巴结转移瘤建立两个LCNEC细胞系,研究不同部位转移瘤细胞系对化疗的反应。结果发现两个细胞系均对顺铂、依托泊甙和奥沙利铂耐药,但仅胃食管结合部的LCNEC对5-氟尿嘧啶高度敏感。新建立的LCNEC细胞系对深入研究LCNEC的生物学行为及治疗策略均具有重要意义。
9、GEP-NENs的肿瘤前病变 GEP-NENs有无肿瘤前病变,回答是肯定的,但有关胃肠道各器官的肿瘤前病变的描述及报道并不多。新近出版的《胃癌外科病理新进展》将胃的非肿瘤性神经内分泌细胞改变分为增生和异型增生。增生病变的细胞被认为缺乏明显的致瘤潜能,依细胞增生程度分为单纯性、线性、微结节性及腺瘤样增生,总体分布范围<150μm(图10)。异型增生被称为肿瘤前病变,其病变位于固有层内,范围在150~500μm之间。依增生细胞簇大小分为:(1)扩大性微结节;(2)融合性微结节,因基膜消失导致相邻微结节互相融合而成;(3)微浸润性病变,固有层腺体间隙内浸润;(4)结节伴新间质形成,显示微结节状或小梁状结构。异型增生病变通常见于邻近NET的黏膜内。A型慢性萎缩性胃炎与胃神经内分泌细胞增生关系最为密切,可以出现上述不同的肿瘤前病变。 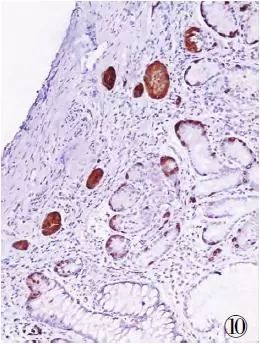
图10神经内分泌细胞增生:胃窦深部黏膜部分腺体及细胞Syn阳性,EliVision法
10.生长抑素受体检测与GEP-NENs的治疗 生长抑素类似物(somatostatin analog,SSTA)是目前GEP-NENs唯一成熟的激素治疗方法。SSTA的作用机制是其不仅能够抑制肿瘤释放激素,而且高剂量的SSTA有诱导细胞凋亡的作用,可作为一种抗增殖因子稳定肿瘤远处转移灶的生长,延长患者生存期。目前人工合成的长效SSTA,常用的有奥曲肽(Octreotide)、兰瑞肽(Lanreotide)等。
由于80%~90%的NENs表达生长抑素受体(somatostatinreceptor,SSTR),从理论上讲,通过利用生长抑素受体显像(somatostatinreceptor scinfigraphy,SRS)放射性核素标记的SSTA与肿瘤表面的SSTR特异性结合的特点,能够显示肿瘤的原发灶及转移灶。该技术是显示SSTR的标准方法,也是肿瘤分期和首选SSTA治疗的标准方法。
临床上很多GEP-NENs是术后才获得明确诊断,因此,鉴于诊断和治疗上的需要,尤其是在应用SSTA之前需行SSTR检测以确定对SSTA治疗的敏感性。SSTR有5种亚型(SSTR1~5),可以通过免疫组化及RT-PCR法进行检测。现有资料表明,SSTR的检测,不仅有助于GEP-NENs的诊断与治疗,而且某些SSTR亚型的过表达还有助于预测SSTA治疗患者的临床转归。
|