登陆查看更多优秀资源帖,与同道便捷交流讨论
您需要 登录 才可以下载或查看,没有帐号?立即注册
x
除了“良恶”之分,肿瘤更有 “冷热” 之分
根据肿瘤生长特征及对机体危害程度的不同,可分为 “恶性” 和 “良性” 两大类。肿瘤的冷热又该如何划分?
根据肿瘤微环境中免疫细胞的空间分布情况,将肿瘤分为三种基本的免疫表型:免疫炎症型 (immune-inflammed)、免疫排斥型 (immune-excluded) 和免疫沙漠型 (immune-desert 表型)。
免疫炎性肿瘤即为 “热肿瘤”,其特点是 T 细胞高浸润、干扰素-γ 信号通路升高、PD-L1 表达和高肿瘤突变负担 (TMB:TMB 越高,产生的新抗原可能越多,肿瘤免疫原性也越高)。免疫排斥瘤和免疫沙漠瘤皆可称为 “冷肿瘤”,在免疫排斥瘤中,CD8+ T 淋巴细胞定位于侵袭边缘,不能有效地浸润肿瘤;免疫沙漠肿瘤中,肿瘤及其周围不存在 CD8+ T 淋巴细胞。
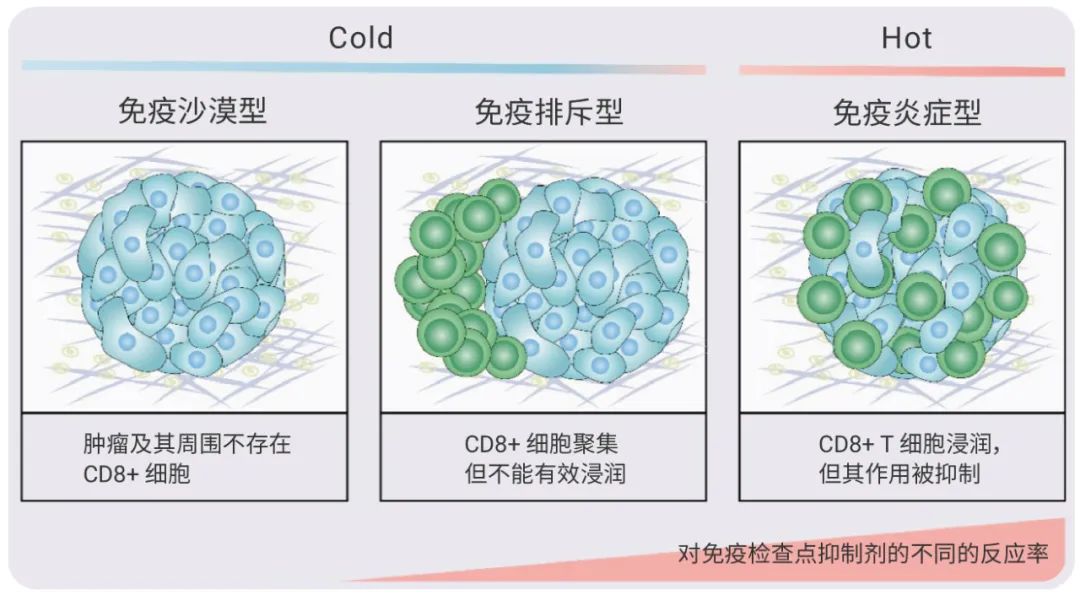
图 1. 根据免疫细胞分布区分 “冷热” 肿瘤[1]
冷肿瘤微环境的免疫抑制机制:除了较差的 T 细胞浸润外,冷肿瘤的 TME 中,T 细胞启动可能被抑制,此外,病灶中细胞外基质的沉积和 “僵硬” 基质诱导的缺氧建立物理和化学屏障阻碍 T 细胞浸润。免疫抑制细胞群也存在于冷肿瘤中,它们抑制 CD8+ T 细胞的功能 (如图 2 所示)。
总之:冷肿瘤缺乏先天免疫,或者 “冷肿瘤” 中存在先天抗肿瘤免疫特征。
图 2. 肿瘤免疫微环境在冷肿瘤中的免疫机制[2]
当 “冷热” 肿瘤撞击免疫检查点
免疫检查点指 T 细胞表面抑制免疫激活的抑制性通路。免疫检查点抑制剂 (immune checkpoint inhibitors, ICIs) 作为常见的肿瘤免疫疗法,可通过抑制免疫检查点活性,重新激活 T 细胞对肿瘤的免疫应答效应,从而达到抗肿瘤的效果。在 “热” 肿瘤中,免疫细胞较为活跃,其内环境也被大量的 T 细胞所侵袭,当 ICIs 解除免疫检查点的抑制作用后,T 细胞对肿瘤的免疫应答效应再次被启动,活化的 T 细胞杀伤癌细胞,起到免疫治疗作用。
因此,具有炎症表型的 “热肿瘤” 往往对 ICIs 更敏感;但对于 “冷肿瘤” 来说,免疫细胞很难识别并杀伤,免疫检查点抑制剂也就难以发挥作用。使 “冷肿瘤” 变身 “热肿瘤”,从而提高对肿瘤免疫疗法的响应率和治疗效果,是目前肿瘤治疗领域研究的热点问题之一。那么,如何让冷肿瘤顺利变身?
将冷肿瘤转化成热肿瘤?
■ 将 T 细胞驱动到冷肿瘤中,“点燃” 冷肿瘤以提高 ICI 的疗效 STING 激动剂,溶瘤病毒、光热疗法和光动力疗法、化学疗法和放射疗法等都能够诱导免疫原性细胞死亡 (ICD) 以促进 T 细胞的启动和活化。
以干扰素基因刺激因子 (STING) 为例,STING 可诱导细胞因子如干扰素 (IFNs) 的分泌,激活 T 细胞介导的先天性免疫反应;激活的免疫系统会改变肿瘤的免疫表型,将其从对 T 细胞反应性低的 “冷” 变成了对 T 细胞反应性高的 “热”。 如下图,在Development of Potent Immune Modulators Targeting Stimulator of Interferon Genes Receptor 一文中,STING 激动剂 4c 可显著降低 CT26 小鼠结肠直肠癌模型的肿瘤体积,有效抑制小鼠肿瘤细胞的生长。此外,在 4c 处理的小鼠模型中,由于免疫记忆,在没有二次给药的情况下,复发肿瘤的生长也被抑制。这些结果表明,4c 具有通过 STING 介导的免疫激活实现癌症免疫治疗的潜力。此外,Science 也曾报道:MSA-2 (STING 激动剂) 刺激肿瘤的 IFN-β 分泌,并诱导肿瘤消退,并且在 PD-1 阻断反应低的小鼠肿瘤模型中增加肿瘤 CD8+ T 淋巴细胞的浸润。 图 3:STING 介导的免疫激活实现癌症免疫治疗[3]
■ 增加免疫检查点丰度,促进 T 细胞的有效地浸润肿瘤,“助” 冷肿瘤变热今年 3 月,武汉大学张金方教授课题组在肿瘤免疫治疗领域的新成果 “USP8 inhibition reshapes an inflamed tumor microenvironment that potentiates the immunotherapy”。该研究揭示抑制去泛素化酶 USP8 可重塑肿瘤免疫微环境 (TME),使 “冷肿瘤” 变成 “热肿瘤”,从而提高肿瘤免疫治疗效果的分子机制。
文章结果表明,在体外抑制 USP8 能够增强 PD-L1 K63 位连接的泛素化修饰,并上调 PD-L1 的蛋白水平。此外,USP8 抑制剂 DUB-IN-2 与 anti-PD-L1 抗体的联合治疗显着抑制肿瘤生长,并提高了 MC38 荷瘤免疫活性小鼠的总体存活率 (图 4a)。此外,结果还表明 DUB-IN-2 联合抗 PD-L1 治疗显着显着增加 CT26 肿瘤的 CD8+ T 细胞的百分比 (图 4b),还提高了 GzmB (T 细胞激活标志物 Granzyme B) 的表达并降低了浸润的 CD8+ T 细胞上 TIM3 (耗竭T 细胞标志物) 的表达 (图 4c-d)。该研究为开发新的肿瘤免疫联合治疗方案提供分子基础和理论支持。
图 4:USP8 重塑肿瘤免疫微环境 (TME)[4]
■ 以纳米粒子为基础的使肿瘤变热的治疗方法
除了上述方法,纳米药物与免疫疗法相结合是近年的研究趋势,纳米药物助力 “冷肿瘤” 向 “热肿瘤” 的转变,主要有如下 4 种不同的靶向途径:
(1) 靶向物理屏障和基质细胞,用纳米载体改善了肿瘤靶向性并保护有效载荷免于降解在 TME 内,可促进免疫细胞和疗法的更好渗透;(2) 使用 NPs 包裹的 siRNA 降低癌细胞的关键蛋白的表达,抑制细胞侵袭、迁移;(3) 靶向细胞因子信号,增强免疫反应等;(4) NPs 递送的小分子诱导细胞应激、免疫原性细胞死亡。
小结:1. 冷热肿瘤的区分主要在于免疫细胞的空间分布情况,且冷肿瘤往往对免疫治疗 “迟钝”。2. 通过增加肿瘤抗原的表达和恢复抗原加工和呈递机制来促进 T 细胞启动 (如 STING 激动剂);以及对肿瘤微环境进行重新编程,促进 T 细胞运输并使 T 细胞更有效地浸润肿瘤。这些方法都可帮助 “冷” 肿瘤转化为 “热” 肿瘤,从而提高免疫治疗效率。
MCE 的所有产品仅用作科学研究或药证申报,我们不为任何个人用途提供产品和服务
参考文献 1. Yuan-Tong Liu, Zhi-Jun Sun. Turning cold tumors into hot tumors by improving T-cell infiltration. Theranostics. 2021 Mar 11;11(11):5365-5386. 2. Qinjun Chen, Tao Sun, Chen Jiang, et al. Recent Advancements in Nanomedicine for 'Cold' Tumor Immunotherapy. Nanomicro Lett. 2021 Mar 16;13(1):92.
3. Min Jae Jeon, Hyelim Lee, Jeehee Lee. Development of Potent Immune Modulators Targeting Stimulator of Interferon Genes Receptor. J Med Chem. 2022 Apr 14;65(7):5407-5432.
4. Wenjun Xiong, Xueliang Gao, et al. USP8 inhibition reshapes an inflamed tumor microenvironment that potentiates the immunotherapy. Nat Commun. 2022 Mar 31;13(1):1700.
5. Giulio Giustarini, Andrea Pavesi, Giulia Adriani. Nanoparticle-Based Therapies for Turning Cold Tumors Hot: How to Treat an Immunosuppressive Tumor Microenvironment. Front Bioeng Biotechnol. 2021 Jun 2; 9:689245.
|