和细胞第一次见面的时候我们要做好什么准备呢?快跟着小M 一起看看吧~
▐01 记录细胞重要信息
当第一次在实验室接收细胞系时,有几条与细胞系有关的信息应该被整理和记录,这些将确保细胞系的成功繁殖、扩增、冷冻保存和储存。小 M 强烈建议在细胞扩增开始之前记录以下信息:(1) 背景信息,(2) 传代培养,(3) 冷冻保存,(4) 细胞系储存。
表 1. 需要记录与细胞系有关的信息[1]。
注意:细胞培养时,连续细胞系在培养中会发生变化。然而,许多研究已经证明了长期培养对细胞系形态、发育和基因表达的各种影响:如细胞生长变异,导致细胞污染等。因此,当第一次将细胞系接收到实验室时,留有低传代的细胞种子库是非常重要的。
▐02 培养细胞的形态观察
监测和记录细胞形态和行为是十分重要的,推荐做法是在传代培养之前定期仔细地检查培养细胞,以确定其状态和健康状况。细胞形态观察结果可以帮助“科研汪”们判断 (1) 细胞的形态:健康 or 恶化 (即衰老或坏死的细胞)?(2) 是否存在细胞污染?(3) 区分细胞及细胞密度。
大多数细胞培养生长为:悬浮培养和贴壁培养。然而,在某些情况下可能会观察到悬浮和贴壁的混合群体。
培养中的动物细胞的形状可分为三个基本形态:成纤维细胞样(Fibroblast-like)、上皮细胞样(Epithelial-like) 和类淋巴母细胞样(Lymphoblastoid-like)。
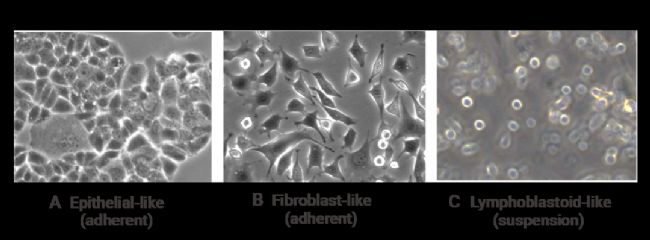
图 1. 培养细胞的一般特征和形状[1]。
(A) 上皮样 (贴壁);(B) 成纤维细胞样 (贴壁);(C) 淋巴母细胞样 (悬浮液)。
(以收到 T25 培养瓶为例)
1. 先观察培养基颜色以及是否有漏液情况,再在倒置显微镜下观察细胞状态,并对细胞进行不同倍数拍照,排除细胞本身污染或状态不好的情况;
2. 确认细胞状态正常后将细胞瓶外壁消毒,放在培养箱静置数小时 (根据细胞密度定) 以稳定细胞状态;
3.1 贴壁细胞:细胞生长密度超过 80% 时,可根据情况传代,若细胞未超过80%汇合度时,可对其培养基进行半换液处理,即吸去一半的原培养基 (不要丢掉可以留给细胞过渡用),再加入等量的完全培养基继续培养,直至细胞密度超过 80% 以后再进行传代;
3.2 悬浮细胞:将细胞培养瓶内液体转移至离心管,500 g 离心 5 min,温柔的倒出上清液 (也可以先保留下来以备不时之需),管底细胞沉淀加入 10 mL 完全培养基吹打、重悬。放入新的细胞培养瓶中培养过夜,根据细胞密度及生长情况分瓶传代。
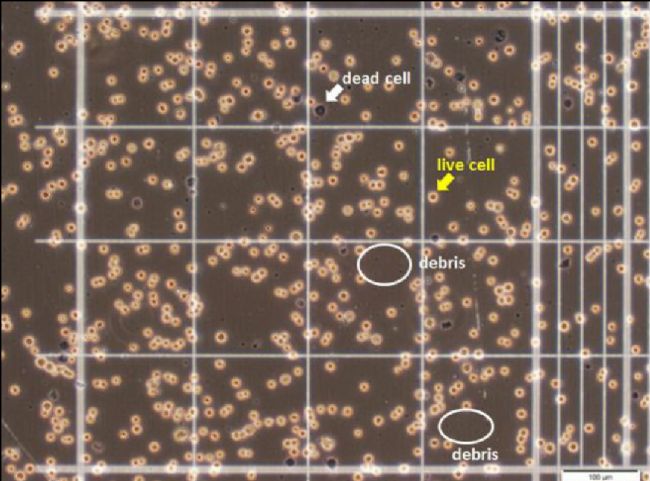
图 2. 台盼蓝染色图[2]。
4. 细胞计数:无血清培养基将细胞悬液稀释到 200-2000 个/毫升,在 10-100 µl 的细胞悬液中加入等体积的 0.4% 的台盼蓝溶液。轻轻混匀,用血球计数板计数细胞。活细胞排斥台盼蓝,依旧是透亮的状态,死细胞会被染成蓝色。有细胞计数仪的,可直接用计数仪进行计数更方便哦~
选择合适的培养基对于细胞培养的成功至关重要,不同类型的细胞具有不同的生长需求和特定的培养条件。
首先,培养基中的营养物质是维持细胞生长和代谢所必需的。不同类型的细胞需要各种不同的氨基酸、糖类、维生素、无机盐和脂质等营养物质以满足其生理需求。如果培养基中缺乏必要的营养物质,细胞可能无法正常生长和分裂,甚至会导致细胞死亡[3][4]。
选择合适的培养基的时候优先根据细胞来源公司提供的培养条件,无法确定来源的可以参考 ATCC 推荐细胞对应培养基。
表 2. 常见细胞的培养体系。
其次,不同类型的细胞需要特定的生长因子和激素来维持其特定的功能和特性。例如,神经细胞培养基中通常添加神经营养因子,以促进神经细胞的生长和突触形成;胎牛血清通常被添加到培养基中,提供细胞所需的生长因子、蛋白质和其他重要组分。
此外,必要时候也可以加入抗生素来防止污染保卫细胞。例如双抗 (青霉素/链霉) 甚至三抗 (青霉素、链霉素、两性霉素 B) 以抑制细菌和真菌等微生物的生长,青霉素-链霉素可有效抑制多数革兰氏阳性菌 和革兰氏阴性菌的生长,两性霉素 B 可用于抑制真菌、酵母的污染。
随着时间的推移,细胞的数量会增加,而空间和资源却有限。所以,当细胞达到一定密度时,就该考虑给他们一个更广阔的居住空间,让他们继续昌盛繁衍。
图 3. 传代流程图。
常见的细胞传代步骤参考如下:
(以 T25 培养瓶为例)
1. 从培育箱中取出细胞,显微镜下观察细胞,汇合度大于 80% 即可传代;
2. 准备操作:培养基和 PBS 放置 37℃ 水浴锅预热,将传代所用耗材(移液管、移液枪、T25 培养瓶、枪头等) 放入超净工作台,紫外灭菌 30 min 后通风,将胰酶和预热后的培养基以及 PBS 用 75% 酒精消毒后放入超净工作台;
3. 吸弃培养瓶内旧培养液,5 mL PBS 润洗细胞,吸弃 PBS;
4. 加入 1 mL 胰蛋白酶,轻晃培养瓶使胰蛋白酶充分覆盖细胞,放入 37℃ 培养箱中孵育 30 s-2 min (实际孵育时间因所使用的细胞系而异);
5. 显微镜下观察,当 ≥90% 的细胞脱落时,加入两倍胰酶体积的含血清的完全培养基,终止消化,吹打细胞层表面数次,使其分散成单个细胞;
6. 500× g 离心 3-5 分钟,将细胞沉淀重悬于含血清的完全培养基;
7. 将细胞悬液按传代比例分装到培养瓶,补充新鲜完全培养基,轻晃培养瓶使细胞分布均匀,并做好标记;
8. 显微镜下观察细胞密度及状态,把细胞送回培养箱。
注意:利用胰蛋白酶进行动物细胞传代培养时需要考虑许多因素。胰蛋白酶具有水解蛋白质的活性,可影响细胞的多种生理代谢功能。
Tips:胰蛋白酶传代培养细胞的最佳方法
在添加胰蛋白酶之前,用不含 Ca2+ 和 Mg2+ 的生理盐水/PBS 清洗,以去除这些离子 (溶液中的 Ca2+、Mg2+ 和血清会降低胰酶活力);
用最低浓度和体积的胰蛋白酶从培养瓶表面去除细胞;
如果可能的话,在室温或更低的温度下使用胰蛋白酶溶液,以减少酶的内吞作用;
尽可能短的时间使用胰蛋白酶处理细胞,避免消化过度影响细胞;
用胰蛋白酶抑制剂如含血清或血清的完全培养基中和终止胰蛋白酶活性,然后用离心除去胰蛋白酶;
细胞脱落后立即离心除去培养瓶表面的胰蛋白酶。
细胞冻存就像是给细胞一个冰冻的时间旅行机票,保证它们在未来可以“解冻”回到活力四溢的状态。这一过程可以确保你的珍贵细胞库不会因为时间的推移而遭受损失。
那么冻存细胞的最佳时机是什么时候?什么样的细胞浓度合适?要用多少冻存液呢?怎么实现细胞的“慢冻”?复苏后第二天发现细胞没有活?好不容易复苏的细胞竟然污染了?怎么才能让细胞满血复活呢?
Fetal Bovine Serum (FBS)
特级胎牛血清,乌拉圭 |
DMEM (High Glucose, L-Glutamine, Pyruvate, Phenol Red, no HEPES)
细胞培养常用培养基 |
DMEM (Low Glucose, L-Glutamine, Pyruvate, Phenol Red, no HEPES)
细胞培养常用培养基 |
RPMI 1640 (L-Glutamine, Phenol Red, no HEPES)
细胞培养常用培养基 |
BM-Cyclin 支原体清除试剂
有效抑制和清除在细胞培养中广泛存在的支原体污染 |
Penicillin-Streptomycin
双抗,可以对许多细菌引起的污染进行有效的控制 |
0.25% Trypsin-EDTA (1x), phenol red
用于细胞解离、常规细胞培养传代及原代组织解离,使组织或贴壁细胞分散成单个细胞 |
[1] Reid YA. Best practices for naming, receiving, and managing cells in culture. In Vitro Cell Dev Biol Anim. 2017 Oct;53(9):761-774.
[2] Aung S M, et al. Live and dead cells counting from microscopic trypan blue staining images using thresholding and morphological operation techniques[J]. International Journal of Electrical and Computer Engineering, 2019, 9(4): 2460.
[3] Jessica Cox, et al. Co-occurrence of Cell Lines, Basal Media and Supplementation in the Biomedical Research Literature. Journal of Data and Information Science. 2020, Vol. 5. Issue (3) : 161-177.
[4] Lee JT, et al. Cell culture medium as an alternative to conventional simulated body fluid. Acta Biomater. 2011 Jun;7(6):2615-22.
[5] Yee Y, et al. Mechanism of penicillin-streptomycin synergy for clinical isolates of viridans streptococci[J]. The Journal of infectious diseases, 1986, 154(3): 531-534.
[6] Baust, et al. Development and Assessment of a Novel Device for the Controlled, Dry Thawing of Cryopreserved Cell Products. BioProcessing Journal. 2016;15. 30-41.